RANGKUMAN KIMIA BAB I KONFIGURASI ELEKTRON DAN SISTEM PERIODIK UNSUR
BAB I
KONFIGURASI
ELEKTRON DAN SISTEM PERIODIK UNSUR
Konfigurasi elektron adalah
susunan elektron berdasarkan kulit atau orbital dari suatu atom. Konfigurasi elektron berdasarkan orbital,
lebih berfungsi untuk mempelajari sifat-sifat suatu zat kimia. Sedangkan sistem periodik unsur adalah susunan unsur-unsur kimia berdasarkan urutan nomor atom.
A. Model Atom
1. Model Atom
Dalton (John Dalton)
Model Atom Dalton adalah model atom yang
paling sederhana, model atom ini menyatakan bahwa Atom merupakan bola pejal yang tidak bermuatan dan tidak bisa dibagi-bagi
lagi.
2. Model Atom
Thompson (Joseph John Thompson)
Model Atom ini berbentuk seperti roti kismis, model atom ini menyatakan
bahwa Atom merupakan bola padat yang
bermuatan positif dengan partikel electron tersebar didalamnya serta dengan
jumlah muatan yang sama. Terdapat percobaan penembakan sinar Katoda
dibelokkan kepelat logam positif.
3. Model Atom Rutherford
(1911)
Model atom ini menyatakan bahwa Setiap atom memiliki muatan positif dan
massa atom diinti atomnya dengan tersebar muatan negative disetiap lintasannya.
Terdapat percobaan penembakan logam dengan sinar alpha (percobaan Geiger-marsden).
4.
Model Atom Bohr (Niels Bohr dan Ernes
Rutherford)
Model atom ini menyatakan bahwa Atom terdiri dari inti atom yang terdapat
proton dan neutron yang dikelilingi electron yang berputar diorbitnya.
5.
Model Atom Mekanika (Modern)
Model atom ini menyatakan bahwa Atom terdiri
dari muatan positif dan muatan negative pada orbitalnya (s,p,d dan f).
Nama Atom Golongan Gas Mulia
|
No Atom
|
Helium (He)
|
2
|
Neon (Ne)
|
10
|
Argon (Ar)
|
18
|
Kripton (Kr)
|
36
|
Xenon (Xe)
|
54
|
Radon (Rn)
|
86
|
Nomor Periode = jumlah Kulit
|
Nomor golongan = jumlah Elektron Valensi (Elektron terluar)
|
B. Pengertian
Isotop, Isobar dan Isoton
1.
Isotop adalah
atom-atom yang mempunyai nomor atom yang sama namun mempunyai nomor massa atom
yang berbeda.
2.
Isobar adalah
atom-atom yang mempunyai nomor massa yang sama namun mempunyai nomor atom yang
berbeda.
3.
Isoton adalah
atom-atom yang mempunyai nomor atom dan nomor massa yang berbeda namun
mempunyai nomor neutron yang sama.
Contoh;
C. Konfigurasi
Elektron
Contoh;
K
|
L
|
M
|
N
|
|
1H
|
1
|
|||
2He
|
2
|
|||
18Ar
|
2
|
8
|
8
|
|
19K
|
2
|
8
|
8
|
1
|
D. Bilangan
Kuantum
Bilangan kuantum adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang di wakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis.
1. Bilangan Kuantum Utama (n)
Bilangan kuantum utama digunakan untuk menentukan tingkat energi elektron dalam suatu atom.
2. Bilangan Kuantum Azimuth (l)
Harga n
|
1
|
2
|
3
|
4
|
Kulit
|
K
|
L
|
M
|
N
|
Bilangan Kuantum Azimuth digunakan untuk menentukan subtingkat energi elektron di dalam suatu atom.
Harga
l
|
0
|
1
|
2
|
3
|
Kulit
|
s
|
p
|
d
|
f
|
3. Bilangan Kuantum Magnetik (m)
Bilangan Kuantum Magnetik digunakan untuk menentukan orbital yang merupakan penyusun subkulit.
Subkulit
|
Harga
|
s
|
0
|
p
|
-1 0 +1
|
d
|
-2 -1 0 +1 +2
|
f
|
-3 -2 -1 0 +1 +2 +3
|
4. Bilangan Spin (s)
Bilangan Spin digunakan untuk menentukan arah putar suatu elektron.
E.
Prinsip Aufbauf
Pengisian elektron dimulai dari tingkat energi yang terendah menuju tingkat energi yang lebih tinggi.
Kulit
|
Jumlah
Kulit
|
Elektron
Valensi
|
Sharp (s)
|
1
|
2e
|
Principle
(p)
|
3
|
6e
|
Difuse (d)
|
5
|
10e
|
Fundamental
(f)
|
7
|
14e
|
Cara menghitung prinsip aufbau adalah sesuai arah anak panah pada gambar dibawah ini;


No
|
Unsur
|
Konfigurasi
|
1.
2.
3.
4.
5.
|
1H
5B
10Ne
17Cl
19K
|
1s1
1s2 2s2
2p1
1s2
2s2 2p6
1s2
2s2 2p6 3s2 3p5
[Ar] 4s1
|
Subkulit
|
Golongan
|
S1
|
IA
|
S2
|
IIA
|
S2 p1
|
IIIA
|
S2 p2
|
IVA
|
S2 p3
|
VA
|
S2 p4
|
VIA
|
S2 p5
|
VIIA
|
S2 p6
|
VIIIA
|
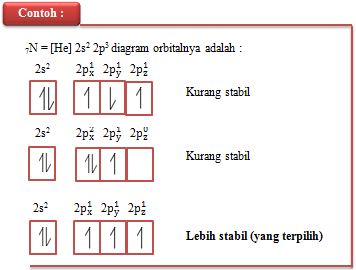
F. Aturan Hund
(Frederick Hund)
Frederick Hund dalam aturan Hund menyatakan bahwa elektron yang
mengisi subkulit dengan jumlah orbital lebih dari satu akan tersebar pada
orbital yang mempunyai kesamaan energi dengan arah putaran yang sama. Pengisian
elektron dimulai dengan mengisi satu elektron pada tiap-tiap orbital dengan
arah putaran (spin) yang sama lalu jika sudah sampai pengisian orbital paling
akhir maka pengisian elektron kembali keorbital pertama dengan arah
putaran (spin) yang berlawanan .
G. Asas
Larangan Pauli
Asas Larangan pauli ini menyatakan bahwa dalam
satu atom tidak mungkin dua elektron mempunyai keempat bilangan kuantum sama.

dari contoh di atas bisa dinyatakan bahwa harga bilangan kuantum utama (n) adalah 3 karena konfigurasi elektron pada unsur S adalah 3p, untuk harga bilangan kuantum azimuth (l) adalah 1 karena konfigurasi elektron pada unsur tersebut adalah p, sedangkan untuk harga bilangan kuantum magnetik (m) adalah -1 karena konfigurasi elektron pada unsur tersebut berakhir pada subkulit p yang dimana subkulit p memiliki 3 kotak yang maksimal hanya diisi oleh 6 elektron sedangkan disitu ada 4 elektron dan pengisian elektro berakhir dengan arah putaran (spin) terbalik jadi harga bilangan kuantum azimuth nya adalah -1 sekaligus menyatakan bahwa harga bilangan spinnya adalah -1/2
H. Sifat
Keperiodikan Unsur
Sifat-sifat
|
Periode
|
Golongan
|
Jari-jari atom
|
← Tambah besar
|
↓ Tambah Besar
|
Energi ionisasi
|
→ Tambah besar
|
↑ Tambah Besar
|
Afinitas elektron
|
→ Tambah besar
|
↑ Tambah Besar
|
Keelektronegatifan
|
→ Tambah besar
|
↑ Tambah Besar
|
- Jari-jari atom adalah jarak antara inti atom dengan kulit terluar
- Energi ionisasi adalah energi yang diperlukan oleh atom untuk melepaskan 1 elektron dari kulit terluarnya
- Afinitas elektron adalah energi yang dibebaskan suatu atom untuk menerima suatu elektron
- Keelektronegatifan adalah kemampuan relatif suatu atom untuk menarik elektron dalam pembentukan molekul
- Keelektropositifan adalah kemampuan relatif suatu atom untuk melepaskan elektron pada kulit terluarnya
Sifat Logam Semakin kearah kiri maka semakin membesar
|
Titik leleh semakin kearah kiri semakin membesar
|
Sifat reduktor semakin kearah kiri maka
semakin membesar
|
Golongan
|
Sifat unsur
|
1. Unsur golongan IA
|
|
2. Unsur golongan IIA
|
|
3. Unsur golongan VIIA
|
|
4. Unsur golongan VIIIA
|
|







Comments
Post a Comment